FACE
日本生化学会北陸支部第28回大会 学生ベスト発表賞受賞

工学研究科 生物応用化学専攻2年
道林 泰樹
学生ベスト発表賞を受賞して
私は2010年5月に開催された日本生化学会北陸支部第28回大会で「ギ酸オキシダーゼの立体構造と補酵素の解明」という演題で発表し、学生ベスト発表賞を頂くことができました。
私の研究室では、アルデヒドオキシダーゼとギ酸オキシダーゼ(FOD)を用いた有害化学物質ホルムアルデヒドの除去について研究をおこなっています。この2つの酵素の中でもFODは、私の研究室が発表した論文を除くと一報あるだけという、ほとんど研究されていない酵素です。今までの私の研究室の研究により、FODは、FADを補酵素とするGMCオキシドリターゼファミリーに属する酵素ですが、補酵素として修飾されたFADを持つことが分かっていました。
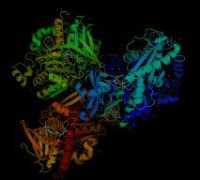 本演題の研究では、FODの反応機構を解明することを目的に、大きく分けて二つのアプローチを行いまいした。一つ目は、活性部位のアミノ酸残基と補酵素との位置関係を含む酵素立体構造を特定するための、結晶化した酵素のSPring-8でのX-線結晶解析です。二つ目は、修飾FADの構造の確定するための、1H-NMRやLC-MS の測定です。X線結晶解析から酵素立体構造を構築することにより、GMCオキシドリターゼファミリーに属する他の酵素の活性発現に重要な役割を果たすHis-Hisペアー又はHis-Asnペアーに対応する位置に、FODでは511His-554Argペアーがあることが分かりました。さらに、511Hisや554Argに遺伝子変異を導入し、発現させた変異体酵素の性質を検討することで、511His-554ArgペアーがFODの活性発現に重要であることが分かりました。また、1H-NMRとLC-MS の測定結果、及びX-線結晶解析から得た修飾FADの電子密度マップより、修飾FADが8-formyl FADまたはその水和体であることが分かりました。現在は、さらに酵素の反応機構の解明を進めるため及び、新たに課題としたFAD修飾機構を解明するため、種々の変異体の作製とその性質の検討、変異体の結晶化などを行っています。
本演題の研究では、FODの反応機構を解明することを目的に、大きく分けて二つのアプローチを行いまいした。一つ目は、活性部位のアミノ酸残基と補酵素との位置関係を含む酵素立体構造を特定するための、結晶化した酵素のSPring-8でのX-線結晶解析です。二つ目は、修飾FADの構造の確定するための、1H-NMRやLC-MS の測定です。X線結晶解析から酵素立体構造を構築することにより、GMCオキシドリターゼファミリーに属する他の酵素の活性発現に重要な役割を果たすHis-Hisペアー又はHis-Asnペアーに対応する位置に、FODでは511His-554Argペアーがあることが分かりました。さらに、511Hisや554Argに遺伝子変異を導入し、発現させた変異体酵素の性質を検討することで、511His-554ArgペアーがFODの活性発現に重要であることが分かりました。また、1H-NMRとLC-MS の測定結果、及びX-線結晶解析から得た修飾FADの電子密度マップより、修飾FADが8-formyl FADまたはその水和体であることが分かりました。現在は、さらに酵素の反応機構の解明を進めるため及び、新たに課題としたFAD修飾機構を解明するため、種々の変異体の作製とその性質の検討、変異体の結晶化などを行っています。
今回このような名誉ある賞を受賞できたことを大変光栄に感じています。また自身の研究に対するモチベーションをより一層高めることが出来ました。今後も全力で研究に取り組みFODの反応機構の全容を解明したいと考えています。
最後に本研究を行うにあたり、終始適切な御指導、御鞭撻を賜りました本学の 内田博之教授、永長幸男名誉教授、 沖昌也准教授、徳永雄次准教授と、京都大学農学研究科 三上文三教授に厚く感謝の意を表します。また、御協力いただいた本講座の方々に深く感謝いたします。